Documenti Pfizer appena rilasciati da FDA: BioNTech ha pagato $ 2.875.842 per l’approvazione del vaccino COVID-19

Mentre il mondo è concentrato sulla situazione in Ucraina, la FDA ha rispettato l’ordine del tribunale di iniziare a rilasciare 55.000 pagine di dati Pfizer al mese, documenti che sono stati utilizzati per autorizzare il vaccino COVID-19 prodotto con BioNTech. Il primo lotto è stato rilasciato tranquillamente ieri, 1 ° marzo.
Ci sono 150 documenti che il pubblico può ora scaricare qui.
Uno dei documenti rilasciati è stato il “Prescription Drug User Fee Payment” che BioNTech ha pagato alla FDA il 20/04/2021 per il “VACCINO mRNA COMIRNATY COVID-19” che la FDA ha successivamente approvato nell’agosto del 2021.
Quel “Prescription Drug User Fee Payment” ammonta a $ 2.875.842,00. (Fonte.)
Un altro documento interessante è l’ “EXTERNAL DATA MONITORING COMMITTEE” che si trova qui.
Ecco lo scopo dichiarato di questo “Comitato esterno di monitoraggio dei dati“:
Questo Comitato di monitoraggio esterno dei dati (E-DMC) (di seguito denominato “il comitato“) è un gruppo consultivo unico, esterno, indipendente ed esperto, istituito per supervisionare i dati di sicurezza ed efficacia del programma di vaccinazione BNT162. La motivazione principale per l’istituzione del comitato è assicurarsi che siano in atto adeguate salvaguardie esterne per contribuire a garantire la sicurezza dei soggetti e mantenere il rigore scientifico e l’integrità dello studio mentre lo studio è in corso.
Il comitato esaminerà i dati di sicurezza accumulati in tutti gli studi, nonché i dati di efficacia nella parte di fase 2/3 dello studio C4591001. Il comitato consiglierà Pfizer per quanto riguarda la sicurezza dei partecipanti attuali e di quelli ancora da reclutare, nonché la continua validità scientifica dello studio. Oltre alla revisione della sicurezza da parte del comitato, il personale qualificato di Pfizer esaminerà i dati di sicurezza come specificato nel piano di revisione della sorveglianza di sicurezza e informerà il comitato dei risultati significativi. I dati di efficacia dello studio C4591001 saranno a disposizione del comitato quando è prevista un’analisi intermedia dell’efficacia o se questa è ritenuta necessaria per condurre una valutazione rischio-beneficio.
E per assicurarsi che questo Comitato stia facendo il proprio lavoro correttamente per garantire “la sicurezza dei soggetti e per mantenere il rigore scientifico“, chi alla FDA è responsabile di assicurarsi che ciò accada?
NESSUNO. Pfizer è il responsabile e BioNTech lo ha finanziato.
“Pfizer è responsabile della conduzione di questo studio. BioNTech è lo sponsor normativo di questo studio“.
I membri del comitato devono essere liberi da “conflitti di interesse“.
I membri del comitato completeranno un modulo CT22-GSOP-RF01 Independent Oversight Committee Member Conflict of Interest Form. I membri del comitato dovrebbero essere esenti da apparenti conflitti di interesse significativi. Qualsiasi potenziale conflitto di interessi che si sviluppa durante il mandato di un membro nel comitato deve essere divulgato dal membro del comitato.
E chi alla FDA è responsabile di assicurare che questo comitato che sta supervisionando “i dati di sicurezza ed efficacia” sia libero da conflitti di interesse?
NESSUNO. Ancora una volta, Pfizer è responsabile di questo.
“Pfizer determinerà se qualsiasi potenziale conflitto richiede la cessazione dell’appartenenza al comitato”.
La domanda qui è: quale ruolo ha rivestito la FDA, nel monitoraggio “esterno” dei dati per garantire l’integrità e la sicurezza di un nuovo vaccino che stava per essere iniettato in centinaia di milioni di persone negli Stati Uniti?
Sembrerebbe che tutto ciò che hanno fatto sia stato timbrare il processo che è stato completamente gestito da Pfizer e finanziato da BioNTech.
Ecco i membri del “Comitato di monitoraggio dei dati esterni” che apparentemente sono stati scelti da Pfizer, monitorati da Pfizer e indagati da Pfizer per assicurarsi che stessero facendo il loro lavoro e che non ci fossero “conflitti di interesse”.
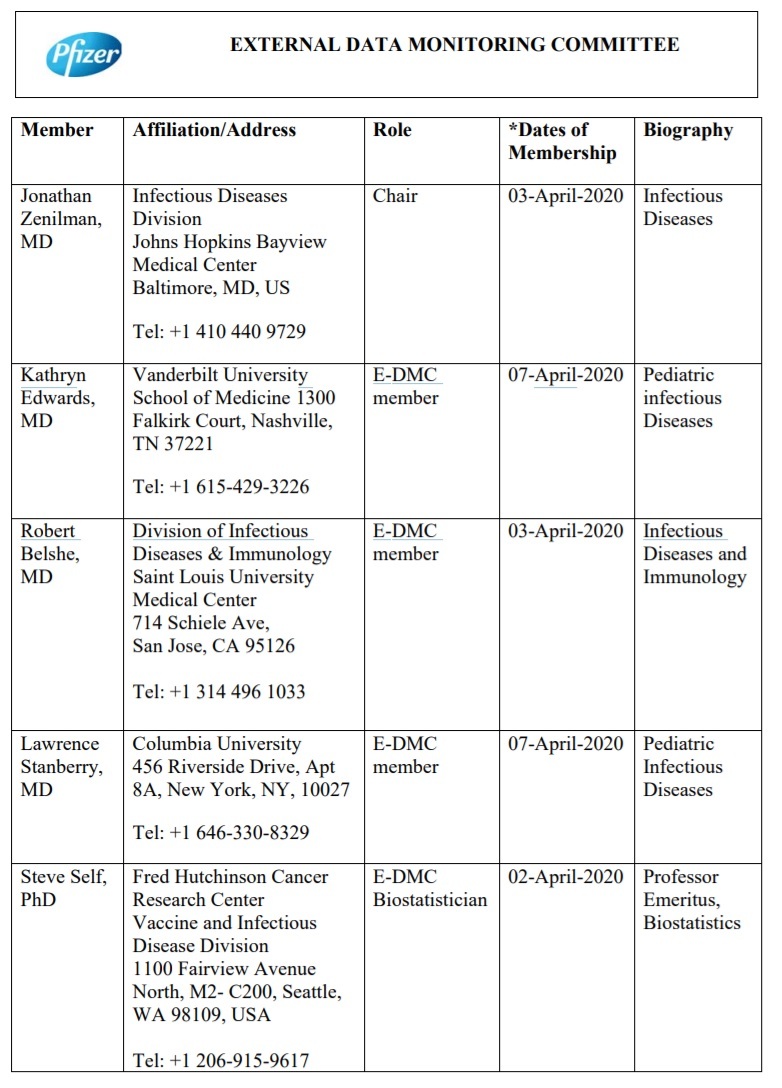
L’altra cosa interessante che questo documento rivela è che un numero significativo di persone che compilano i dati per questo comitato, si trovavano in Cina.
Rong Zhang: Senior Statistical Programming Lead
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Cina, Rong.Zhang@pfizer.com
201203Chen Xu*: Senior Statistical Programmer
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Cina, Chen.Xu4@pfizer.com
201203Huan Liu* Senior Statistical Programmer
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Cina, Huan.Liu@pfizer.com
201203Jiyang Chen*: Programmatore statistico
senior 4/F, Edificio 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Cina, Jiyang.Chen@pfizer.com
201203Bochen Zhu*: Programmatore Statistico
Senior 4/F, Edificio 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Cina, 201203
Bochen.Zhu@pfizer.comRan Xiong*: Senior Statistical Programmer
4/F, Building 3, Lotus Business Park, Lane
60, Naxian Road,
Pudong ZhangJiang Hi-tech. Park, Shanghai,
Cina, Ran.Xiong@pfizer.com
201203
Quindi anche i dati grezzi si trovano in Cina?
Ci sono moltissimi dati ancora da esaminare e decine di migliaia di altre pagine di dati ancora da rilasciare da parte della FDA.
